1. GENERALIDADES
La Presión Intracraneal (PIC) es el
resultado de la relación dinámica entre el cráneo y su contenido. El contenido o
compartimento está constituido por el parénquima cerebral, el volumen sanguíneo
cerebral (VSC) y el volumen del líquido cefalorraquídeo (LCR).
A. Parénquima Cerebral: Conformado
por elementos gliales y neurales. Representa aproximadamente 1100-1200 g y es considerado
constante bajo diversas condiciones adversas.
B. Componente Vascular: Representado por la sangre, distribuida en arterias, arteriolas, capilares, vénulas y el
gran sistema venoso. Su volumen total es de aproximadamente 150 cc pero varía
ampliamente. Interviene en el mecanismo de autorre-gulación cerebral.
C. Líquido Cefalorraquídeo: También representa aproximadamente 150 cc; pero, este volumen puede variar, asimismo
tiene un alto potencial terapéutico en razón de su fácil acceso para su drenaje.
Como se ve, el volumen total del
contenido intracraneal es de aproximadamente 1500 cc de los cuales la mayoría 80%
(parénquima cerebral) es fijo y un 20% (LCR y sangre) y líquido intersticial o H2O es
variable. La variabilidad de estos dos últimos compartimientos explica mucho de los
fenómenos del cambio de la PIC (Gráfico N° 1).
|
|
|
Gráfico N° 1. Compartimientos |
La presión intracraneal (PIC) está
referida a una presión atmosférica, pero por convención se considera a la PIC como la
presión hidrostática del líquido cefalorraquídeo medida a nivel intra-ventricular o en
el espacio subaracnoideo lumbar. Está demostrado que la presión tisular del parénquima
cerebral es similar aunque no exactamente igual a la del líquido cefalorraquídeo (LCR).
La PIC se expresa normalmente en
"mmHg" o en unidades "Torn", aunque existe la tendencia cada vez más
generalizada a expresarla en la unidad internacional, el Kilopascal (Kpa). Se acepta que
en posición decúbito lateral o supino la PIC normalmente es inferior a 15 mmHg. Si la
PIC al ser observada durante un período de tiempo no varía, se considera que los
mecanismos que la controlan están en equilibrio. En esta situación la estabilidad de la
PIC es condicionada por tres variables distintas:
1) El volumen de producción de LCR
(VLCR)
2) La resistencia que ofrece el sistema
de reabsorción en cada individuo a la circulación y absorción del LCR (RLCR).
3) Por la presión venosa (PSC) del
espacio intracraneal, reflejo más o menos exacto de la presión existente a nivel del
seno longitudinal superior.
La relación entre estos parámetros se
expresa con la siguiente ecuación:
PIC = (VLCR + RLCR) + VPC
Las relaciones entre el cráneo
(continente) y su contenido (volumen intracraneal) se definieron bien por la modificación
de la teoría de Monro y Kellie, según la cual en el adulto una vez que las suturas
craneales se han cerrado, el volumen intracraneal (VIC) permanece constante. Debido a que
los tres componentes del VIC no son compresibles, cualquier incremento de volumen, siempre
que la PIC permanezca constante, debe acompañarse necesariamente de la disminución de
uno o más de los componentes intracraneales. En un cerebro indemne los incrementos de la
PIC generan respuestas automáticas de protección en un esfuerzo por mantener un
equilibrio dinámico. Un mecanismo protector del cerebro es su habilidad para desviar el
LCR hacia el espacio subaracnoideo e intrarraquídeo. Otro mecanismo protector muy
importante es la autorregulación cerebral, propiedad por la cual el cerebro asegura el
mantenimiento del Flujo Sanguíneo Cerebral (FSC) constante a pesar de los cambios de la
Presión Arterial Media (PAM) mediante respuestas arteriolares de vasoconstricción o
vasodilatación en respuesta a las alteraciones de la Presión Arterial Sistémica y a los
estímulos químicos: oxígeno (O2), anhidrido carbónico (CO2), ácido láctico y ácido
pirúvico, etc., como puede apreciarse en el esquema o Cascada de Eventos (Cuadro N° 1).
|
Cuadro N° 1. Cascada de Eventos |
|
|
2. DEFINICIÓN
La Hipertensión Intracraneana (HIC) se
define como una elevación sostenida de la Presión Intracraneal (PIC) por encima de sus
valores normales (0-15 mmHg) originada por la pérdida de los mecanismos compensatorios o
ruptura del equilibrio existente entre el cráneo y su contenido (VSC + LCR + VPC)
ocasionando injuria cerebral severa por las alteraciones en el metabolismo y en la
circulación, lo que finalmente se expresará por una serie de manifestaciones clínicas.
3. ETIOPATOGENIA (A)
Todas las condiciones que afectan el
volumen intracraneal (VIC) determinando elevaciones de la PIC pueden originarse en un
incremento del volumen cerebral, del volumen sanguíneo cerebral, del volumen del líquido
cefalorraquídeo así como por volúmenes agregados que ocupen la cavidad intracraneal
(volumen masa), como se muestra en el Cuadro N° 2 y en la Ecuación:
HIC = VSC + VPC + VLCR + Vmasa
|
Cuadro N° 2. Trastornos que |
|
| Volumen cerebral aumentado | – Lesiones ocupantes de espacio como hematomas epidurales y subdurales, tumores, abscesos o aneurismas. – Edema cerebral relacionado con lesiones en la cabeza, paro cardiorrespiratorio y encefalopatías metabólicas. |
| Volumen sanguíneo aumentado
|
– |
| Aumento del LCR
|
– Producción aumentada |
La PIC puede aumentar también por
alteraciones fisiológicas o metabólicas sistémicas, así como por respuestas
farmacológicas, químicas o emocionales (Cuadro N° 3).
|
Cuadro N° 3. Factores que contribuyen |
|
|
|
|
|
Factores |
Causas posibles |
|
|
|
| Hipercapnea (PCO2<45 mmHg) |
Sueño, |
| Hipoxemia (PO2, <50 mmHg) |
Concentración de O2 insuficiente en el tratamiento con oxígeno suplementario, |
|
Vasodilatación cerebral inducida |
Administración de ácido nicotínico,ciclandelato, histamina, clorhidrato de nilidrina y agentes anestésicos como halotano, enfluorano, isofluorano y óxido nitroso. |
|
Maniobra de Valsalva |
Esfuerzo |
|
Posiciones corporales
|
Cualquier posición que obstruya el retorno venoso del cerebro, como tredelemburg, decúbito ventral, flexión extrema de la cadera. |
|
Contracciones musculares |
Ejercicios |
|
Toser/estornudar |
Alergias, resfríos, tos postoperatoria normal. |
|
Sueño REM
|
Los movimientos oculares rápidos se asocian con la actividad cerebral, el despertar también incrementa la PIC. |
|
Trastornos emocionales |
Conversación desagradable o estimulante. |
|
Estímulos nocivos
|
Molestia visceral, |
|
Acumulación de actividades |
Efecto acumulativo de actividades relacionadas con el cuidado, poco espaciadas. |
Al producirse un aumento de la PIC, se
presentan dos fases de ajuste:
Compensación y Descompensación.
En la fase de Compensación, el
cerebro y sus componentes son capaces de alterar sus volúmenes, para permitir la
ubicación de un volumen adicional; la PIC durante esta fase es menor que la presión
arterial (PA) con lo que logra mantener una presión de perfusión cerebral (PPC)
adecuada. En la fase de descompensación al fallar los mecanismos de compensación
la PIC se incrementa modulando alteraciones en la presión de perfusión (PPC) y en el
Flujo Sanguíneo Cerebral (FSC), expresándose clínicamente por cambios en el estado
mental, en los signos vitales a causa del desarrollo de complicaciones como el edema
cerebral y la aparición de conos de presión o herniaciones del parénquima cerebral.
4. FISIOPATOLOGÍA
4.1. Flujo sanguíneo cerebral y
metabolismo cerebral
En la fisiopatología de la
Hipertensión Intracraneal (HIC) el componente vascular desempeña un rol muy importante,
por estar directamente implicado en el mantenimiento del flujo sanguíneo cerebral (FSC) y
de esta manera relacionarse con los otros componentes del cerebro.
El cerebro en el hombre representa el 2%
de su peso corporal total, sin embargo recibe del 12% al 15% del gasto cardíaco (GC) y
consume el 20% del oxígeno (O2) total, a una velocidad aproximada de 3,5 mol O2/100 gr
tejido cerebral por minuto; para mantener este ritmo necesita un flujo sanguíneo que en
promedio es de 45 a 55 ml/100 gr de cerebro/minuto.
Del consumo energético del cerebro
aproximadamente el 60% se utiliza para mantener las funciones electrofisiológicas; es
decir, para mantener las gradientes iónicas para la síntesis, el transporte y la
recaptación de los neurotransmisores. El resto de energía consumida lo emplean las
actividades propias de la homeostasia cerebral.
El flujo sanguíneo cerebral (FSC) no es
uniforme en todo el cerebro, pues en función de sus diversas actividades existen zonas
donde este flujo es diferente en volumen, dándose el llamado flujo sanguíneo cerebral
local (FSCL) al igual que un
índice metabólico cerebral local (IM),
siendo ambos muy heterogéneos; son cuatro veces más altos en la sustancia gris que en la
sustancia blanca, es así que el FSCL en la sustancia gris es de 75 a 80 ml/100 gr/min y
en la sustancia blanca es de 20 ml/100 gr/min.
El metabolismo cerebral determina que la
concentración de O2 en la sangre disminuya en la medida en que ésta circula por el
cerebro para determinar una diferencia arteriovenosa impor-tante; ingresa 19,6 ml/100
gr/min y desciende a 13 ml/100 gr/min al haber atravesado el cerebro. Es sabido que el
cerebro obtiene 6,6 mlO2 de cada 100 ml de sangre (diferencia arterio-venosa) y regresa
6,7 ml CO2, con un cociente respiratorio cercano a 1, lo que indica que utiliza
únicamente carbohidratos.
La glucosa es el único substrato
energético que el cerebro utiliza; los ácidos grasos no atraviesan la Barrera
Hematoencefálica (BHE). El consumo de glucosa por el cerebro es de 10 mg/100 gr de
cerebro y ésta corresponde a casi 75% de la producción hepática, de ésta
aproximadamente el 85% se convierte en CO2 por la vía del ácido tricarboxílico (ATP),
mientras que el 15% se transforma en ácido láctico por glicólisis anaeróbica; el
conocimiento de este proceso es importante para comprender que en los casos en los que
existe una disminución de la concentración del O2, se producirá por esta vía la mayor
cantidad de ácido láctico, el que aumentará la Osmolaridad, determinando la formación
de edema cerebral y consecuentemente incremento del volumen Intracraneal (VIC) y
con ello aumento de la PIC con disminución del FSC; lo que disminuirá el aporte de O2,
iniciando así un círculo vicioso que constituye uno de los pilares en la producción de
la HIC (Diagrama N°1).
El cerebro necesita 12 mmol de ATP/min;
la reserva normal de ATP y de creatinina sólo llega a 8 mmol/min. Ante la ausencia de O2,
la glicólisis anaeróbica puede suministrar otros 15 mmol de ATP/min; ya que la glucosa y
el glucógeno se encuentran en cantidades muy bajas en el tejido cerebral, la glicólisis
anaeró-bica es insuficiente para proporcionar las demandas elevadas del cerebro. Esto
determina un compromiso del estado de conciencia, llegando a su pérdida cuando la PO2
desciende a 20 ó 15 mmHg y a él llega en menos de 10 seg. quedando interrumpido el FSC,
lo que produce en pocos minutos injuria cerebral isquémica irreversible.
|
|
|
Diagrama N° 1 : Efectos de |
4.2. Regulación del flujo sanguíneo
cerebral (FSC)
La fuerza conductora del mantenimiento
del FSC es la presión de perfusión cerebral (PPC). La PPC es una relación matemática
diferencial de la Presión Arterial Media (PAM) y de la presión Intracraneal (PIC).
PPC = PAM – PIC
La PIC es rápidamente mensurable, se
aproxima cercanamen-te a la presión venosa cerebral (PVC). La presión venosa cerebral
(PVC) excede levemente a la PIC para evitar que la presión extravascular la colapse. La
presión venosa es mayor en 2 a 5 mmHg a la PIC.
La PPC influye en la determinación del
flujo sanguíneo cerebral en su relación con la resistencia vascular cerebral (RVC)
FSC = PPC
RVC
Las arterias de gran y mediano calibre al
dividirse en pequeñas arterias y arteriolas se constituyen en los vasos de resistencia
precapilar, y con los capilares explican cerca del 80% del RVC; el 20% RVC es función de
las venas. La resistencia de un vaso sanguíneo es inversamente proporcional a la cuarta
potencia de su radio (r)
RVC = K
r4
El cerebro bajo ciertas condiciones a
pesar de las fluctuaciones de la PPC, puede mantener un nivel constante del FSC,
modificando la Resistencia Vascular Cerebral. Esta capacidad se conoce como
autorregulación cerebral pues es la respuesta vascular que determinará
vasodilatación ante presiones de perfusión cerebral (PPC) bajas y vasoconstricción ante
PPC altas. Son estos cambios compensatorios en el diámetro de los vasos, secundarios a la
presión transmural, los que mantienen el flujo de un modo constante (Fenómeno de
Baylis). La auto-rregulación cerebral tiene límites de efectividad, es así que a una
PPC de aproximadamente 60 mmHg el flujo sanguíneo cerebral comienza a caer rápidamente
dando lugar a un aporte insuficiente de O2, y consecuentemente hipoxia e isquemia ce
rebral. De manera inversa una PPC de 150
mmHg o mayor hará que el flujo sanguíneo cerebral (FSC) aumente rápidamente, llevando a
congestión vascular, disrupción de la Barrera Hematoencefálica (BHE) y consecuentemente
a edema cerebral.
Los límites de la autorregulación no
son inflexibles, se modifican o restablecen por el tono de los vasos, el que puede
alterarse por la hipocapnea o hipercapnea, influencia simpáticos o parasimpáticos, por
la acidosis o alcalosis, por el hipermetabolismo o hipometabolismo, y también por efecto
de diversas drogas.
La curva de la autorregulación (Esquema
N° 1) puede ser desviada a la izquierda permitiendo valores de flujo sanguíneo cerebral
(FSC) más bajos o desviarse a la derecha permitiendo una mayor PPC sin causar
necesariamente una elevación repentina del FSC. En pacientes con HTA crónica la curva de
autorregulación se desplaza a la derecha, representando una adaptación vascular que hace
que estos pacientes puedan tolerar PPC más elevadas. Esta adaptación es el resultado de
la hipertrofia progresiva de la capa muscular media de la pared vascular.
La autorregulación es explicada por
diversas teorías, siendo la teoría miogénica la más factible. Esta teoría
propone que la contracción o relajación de la musculatura lisa resulta de la presión
intramural en distensión por efecto del flujo local intrínseco. La respuesta es rápida,
se inicia en segundos y se completa en cerca de 30 segundos. La integridad del reflejo
depende de influencias hipotalámicas.
|
|
EsquemaN°1: |
4.3. Teoría Neurogénica
Los vasos cerebrales están provistos de
una red de nervios vasomotores simpáticos y parasimpáticos uniformemente distribuidos.
El número de nervios disminuye con la disminución del calibre de los vasos, a pesar de
ello la densidad nerviosa es constante. Está demostrado que esta inervación autonómica
está asociada a la acción de diversos neurotransmisores y neuropéptidos. Se sabe que
los neuropéptidos coexisten con la noroepinefrina en el nervio vasonervorum cerebral,
donde media la prolongada vasoconstricción cerebral.
El sistema colinérgico
parasimpático se origina en el ganglio esfenopalati-no. La acetilcolina ocasiona
vasodilatación a través de los receptores muscarínicos. Dos péptidos, el polipéptido
Intersticial vasoactivo y el polipéptido Histidina-Isoleucina alcanzan la vasculatura
cerebral por sistemas de fibras cercanamente asociadas, ambas median la vasoconstricción.
El rol del control neurogénico, entonces, es la modulación del volumen sanguíneo
cerebral (VSC) y el restablecimiento de la curva de autorregulación.
4.4. Teoría Metabólica
Como se ha señalado el incremento de la
actividad neuronal determina el aumento de la tasa metabólica, condicionando, una mayor
demanda de suministro sanguíneo para proveer de substrato y O2. Esta relación entre FSC
y el metabolismo puede expresarse en la ecuación:
TMCO2 = FSC x DAV O2
100
Donde:
TMCO2 (Tasa metabólica cerebral de
oxígeno)
DAVO2 (Diferencia arteriovenosa de
oxígeno)
El incremento de la actividad metabólica
que lleva a un aumento importante del FSC se aprecia claramente en el "Ictus",
la situación opuesta se observa en la "Demencia", en la Depresión Cerebral por
el uso de barbitúricos, y en otros tipos de coma.
4.5. Control Químico
El FSC es sensible a los cambios de la
presión parcial del dioxido de carbono en un rango de PaCO2 entre 25 y 60 mmHg; la
relación con el flujo sanguíneo cerebral (FSC) es exponencial. La hipocapnea causa
vasoconstricción cerebral, lo que reduce significativamente el VSC, en consecuencia la
hiperventilación se constituye en un arma poderosa para reducir la PIC.
La hipercapnea induce vasodilatación
cerebral, con incremento del VSC y con ello eleva la PIC, ésta es la razón por la que
debe evitarse la hipercapnea en los cuadros clínicos donde se encuentra presente una PIC
elevada.
El efecto de los cambios de PaCO2 ocurre
en minutos, siendo máximo a los 12 minutos. La adaptación ocurre generalmente en 48
horas, con un retorno del FSC a niveles de normalidad. De acuerdo a esta respuesta, el uso
clínico de la hiperventilación no es necesariamente efectiva de manera indefinida, es
por ello que su uso por períodos cortos es más beneficiosa, para contrarrestar los
efectos adversos de la hipercapnea en áreas de daño focal, ayudando así a mantener la
llamada compliansa cerebral.
Los cambios de la PaO2, en menor grado,
también influyen en los cambios del FSC. Las variaciones en las tensiones de O2 a
concentraciones bajas causan vasodilatación y aumento del FSC. Estos cambios aparecen con
una PaO2 de aproximadamente 50 mmHg, se duplican con 30 mmHg y llegan a su máxima
expresión con 20 mmHg; por debajo de él ocurren cambios en la glucólisis, pasando ésta
a la vía anaeróbica (ciclo de Krebs). El efecto vasodilatador es probablemente
secundario a la acidosis láctica, a pesar de que existen evidencias de que el nucleósido
adenosina sería el responsable de la vasodilatación hipóxica. La Adenosina es reducida
por reacciones de fosfo-rilación a nucleótidos, pudiendo acumularse en condiciones de
isquemia. Está demostrado que la Adenosina es un potente vasodilatador cerebral
provocando un aumento de FSC cuando la PPC es baja.
La acción de la Adenosina está mediada
por ajuste en la liberación de radicales libres de calcio, lo que altera la reactividad
del músculo liso. Siendo el CO2 un producto intermedio del metabolismo cerebral es
rápidamente difusible y por tanto tienen un rol importante en la homeostasis
cerebrovascular.
|
|
|
Diagrama N° 2: Efectos |
4.6. Rol de la Viscosidad Sanguínea
La viscosidad sanguínea se eleva con una
concentración alta de glóbulos rojos (Hto), consecuentemente el FSC disminuye, y en
forma inversa un hematocrito bajo disminuye la viscosidad sanguínea e incrementa el FSC,
esto en condiciones normales; pero si la circulación cerebral está incrementada al
máximo, en compensación con un proceso de isquemia, el aumento de la viscosidad
sanguínea será contraproducente.
5. Medición y Monitoreo de la
Presión Intracraneal
Siendo el incremento de la PIC causa
de alteraciones en la dinámica de las relaciones de los componentes intracraneales, su
conocimiento y registro se ha hecho una necesidad para un mejor seguimiento de la
evolución de las alteraciones que ella pueda producir.
Su importancia fue reportada por primera
vez en Francia en el año de 1951 por Guillaume y Janny. Posteriormente, Lundberg en 1960
presentó los resultados de sus estudios, con lo cual se inició una serie de
investigaciones al respecto, determinando la existencia de distintas modalidades con este
propósito.
La medición de la PIC tiene entre sus
objetivos: La identificación de las tendencias de cambio de la presión y sus respuestas
a las medidas destinadas a controlarla. Permite deducir la PPC, importante por indicarnos
las alteraciones que se producirán en el metabolismo cerebral, asimismo permitirá
anteponerse o prevenir la aparición de los conos de presión o herniaciones del tallo
encefálico, que son causa de un rápido deterioro clínico del paciente.
5.1. Registro de la PIC
Para obtener los valores de la PIC se
debe colocar un dispositivo a nivel intracraneal, el que permitirá su registro continuo.
Los dispositivos de uso más común son:
• De Fibra Óptica
• Sistema Hidráulico (lleno
de líquido)
• Un sensor
Los que podrán ser ubicados a nivel
intraparenquimal, intra-ventricular, en el espacio subaracnoideo o en el espacio epidural.
Todos y cada uno de estos sistemas, de acuerdo a su localización anatómica, ofrecen
ventajas y desventajas.
5.2. Componente del patrón de la PIC
El patrón de la curva de la PIC es el
resultado de la transmisión de las ondas de presión arterial y venosa a través del LCR
y del parénquima cerebral.
El patrón normal de las curvas se
asemeja a una curva de presión arterial algo deprimida. La curva normalmente tiene tres o
más picos identificados como P1, P2, P3 (Esquema 2).
|
|
Esquema 2. Ondas del pulso en la A: Trazado normal P1-P2-P3. B: Trazado armónico |
P1 = Llamada onda de percusión,
corresponde a la presión sistólica. Presenta un pico agudo y una amplitud consistente.
P2 = Llamada onda de marea, es el
resultado de la presión en el LCR, tiene una amplitud y forma variable, y termina en una
escotadura dicrótica.
P3 = Llamada onda dicrótica, debido a
que la presión diastólica se encuentra inmediatamente después de la escotadura
dicrótica y declina hacia la posición diastólica basal.
La distensibilidad intracraneal puede
observarse comparando P1 con P2. German (1911) definió la distensibilidad intracraneana
como una expresión del cambio de la PIC, como resultado de la alteración de los
volúmenes intracraneanos. Otros indicadores de los cambios de la distensibilidad son un
aumento sostenido de la PIC por encima de 15 mmHg por más de tres minutos, en respuesta a
cambios en el confort del paciente o en casos de un rápido deterioro neurológico.
5.3. Tipos de Onda
Durante el monitoreo continuo de la PIC
se han identificado tres tipos de ondas (Esquema N° 3):
• Ondas A: "Plateau o en
Meseta"; son un signo ominoso, que indica descompensación intracraneana severa, se
caracterizan por aumentos repentinos con presiones intracraneanas de 50 a 100 mmHg que
duran de 5 a 20 minutos, acompañan al deterioro neurológico. Se producen con intervalos
variables, e indican la inminencia de la producción de herniaciones. Estas ondas de
presión (Esquema N° 3) son las más significativas porque denotan mayor severidad.
• Ondas B: Son oscilaciones
agudas y rítmicas que duran de 0,5 a 2 minutos con PIC que oscila entre 20 a 50 mmHg;
aparecen antes de las ondas Plateau; se presentan en pacientes en quienes la respiración
se hace del tipo Cheyne-Stokes, en estados de somnolencia y durante la fase REM del
sueño.
• Ondas C: Aparecen en la
cresta de las ondas A con una frecuencia de 4 a 8 por minuto y con una amplitud menor a la
de las ondas A y B. No son clínicamente significativas, corresponde a cambios
respiratorios o de la presión arterial (reflejo Traube-Hering-Mayer).
• Ondas no cíclicas: Son
generadas por estímulos externos o internos (generalmente); maniobra de valsalva, durante
la tos, durante la aspiración de secreciones, hipoxia, alza térmica, convulsiones, dolor
y cambios de la posición del paciente.
6. TIPOS DE MONITOREO
a) Catéter intraventricular o drenaje
ventricular externo (medición intraventricular). Se coloca en el Ventrículo Lateral del
lado no dominante, a través del cuerno anterior, hasta el agujero de Monro. Tienen la
ventaja de que permite una medición directa de la PIC, el drenaje de LCR si fuera
necesario, para disminuir la PIC. Tienen la desventaja de que no es fácil de colocar en
presencia de PIC muy elevada, asimismo existe el riesgo de hemorragia intraparenquimal y
alto riesgo de infección (Esquema N° 4).
| PIC |  |
|
|
|
| Respira |  |
|
|
|
| PIC |  |
|
|
|
| PIC |  |
|
|
|
| BP |  |
|
|
|
|
Esquema N° 3. Ondas |
|
|
|
|
Esquema N° 4 : Sitios de |

b) Tornillo subaracnoideo. El sistema es
colocado a través de un agujero de trepanopunción, insertándose el tornillo en el
espacio subaracnoideo. Tiene la ventaja de que su colocación es rápida y adecuada, y la
desventaja de infección en el 1%, que aumenta a partir del tercer día (Tornillos de
Richmond y el aparato de Leeds).
c) Monitoreo epidural (fibra óptica de
Laad). Se inserta un equipo como un balón de radio de transmisión o transductor de fibra
óptica, entre el cráneo y la duramadre. Tiene la ventaja de ser poco invasivo y la
desventaja de que los valores de PIC son discutibles. No drena LCR.
d) Monitoreo intraparenquimal. Se dispone
del sistema de "Camino" de fibra óptica y del microtransductor Honeywell. Tiene
la ventaja de que se puede utilizar en pacientes con TEC severo, cuando las otras
modalidades no ofrecen facilidades. Usualmente las sondas se insertan a 2 ó 3 cm dentro
de la sustancia blanca, por tanto, el riesgo de daño cerebral no es mayor que con el
catéter intraventricular.
CUADRO Nº 4
DISPOSITIVOS PARA LA MONITORIZACIÓN DE LA PIC
|
Dispositivo |
Ventajas |
Desventajas |
| Catéter Intraventricular |
"Patrón de oro" para mediciones, drenaje del líquido cefalorraquídeo |
Cambios de posición del trnsductor con cambios de posición de la cabeza, oclusión de columna por aire o restos cerebrales |
| Tornillo Subaracnoideo |
No hay violación del tejido cerebral; tasa de infección muy baja |
Cerebro edematizado puede producir mediciones falsamente bajas, cambios de posicón del transdcutor con cambios de posición de la cabeza. |
| Transductor de fibra óptica |
Puede insertarse en el parénquima cerebral, ventrículo lateral o en el espacio subdural; alta resolución independiente de cambio de posición de la cabeza |
Una vez insertado no se puede recalibrar , muy costoso, ruptura de la fibra óptica |
6.1. Indicaciones para la
monitorización de la PIC
a. En pacientes con compromiso del estado
de conciencia con una puntuación de siete o menos en la Escala de Coma de Glasgow.
b. En pacientes en quienes el tratamiento
médico empírico de la PIC no evidencia mejoría clínica.
c. Pacientes con patología
multisistémica, que presentan compromiso de conciencia que, a causa del manejo de las
injurias diversas, pueden tener un efecto nocivo sobre la PIC.
d. Inconsistencia clínica con los
hallazgos motores de laterali-zación y,
e. En el postoperatorio de patología
intracraneal severa.
6.2. Contraindicaciones
Éstas son relativas:
a. Pacientes despiertos en quienes la
evaluación neurológica es suficiente.
b. En presencia de coagulopatías, los
diversos procedimientos pueden descencadenar hemorragias o hematomas intraparenquimales.
El monitoreo debe descontinuarse cuando
la PIC se ha normalizado después de 48 a 72 horas de haber interrumpido la terapia
orientada al tratamiento de la PIC elevada. Debe entenderse que la elevación de la PIC no
siempre es de instalación rápida; generalmente debe guiarse por la evolución del cuadro
clínico, para evitar de este modo la sensación equivocada de seguridad de una PIC
normal, cuando el monitoreo fue instalado precozmente.
7. MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas a
consecuencia del incremento de la PIC son conocidas desde los tiempos de Von Begman, Hell,
Kocher, Cushing y Canon, quienes señalaban la tríada clásica: cefalea, vómitos y edema
de papila. Kocher, en 1901, en base a estudios experimentales, plantea que el cuadro
clínico pasa por cuatro estadios progresivos:
a. Estadio de acomodación: Determinado
por la compresión de las venas y capilares cerebrales, desplaza el LCR del compartimiento
intracraneal al intrarraquídeo, para acomodar la masa
agregada. Este estadio se manifiesta con
dolor de cabeza, apatía, somnolencia y distensión de las venas retinales.
b. Estadio temprano: La isquemia relativa
de la médula, como resultado de la congestión vascular, causa la estimulación de los
centros vitales que enlentecen la frecuencia cardíaca y la frecuencia respiratoria e
incrementan levemente la presión arterial sistémica. El dolor de cabeza del paciente
empeora, aparece intranquilidad y confusión.
c. Estadio avanzado: La PIC moderada o
severa causa isquemia medular amplia y estimulación máxima de los centros vitales. La
frecuencia cardíaca disminuye alrededor de 50 por minuto, la presión arterial es
intermitentemente alta, la presión del pulso se amplía, la frecuencia respiratoria se
hace irregular, con períodos de respiración del tipo Cheyne-Stoke y períodos de apnea.
Las pupilas se hacen irregulares en forma y tamaño, aparece edema de papila evidente y
congestión de las venas retinales. El paciente se halla en coma, y si el tratamiento no
es eficaz, pasa al estadio siguiente.
d. Estadio de falla medular: La PIC alta,
al no ser controlada, causa colapso de los centros medulares sobreestimulados. Es un
estadio terminal e irreversible; el paciente se halla en coma profundo, las pupilas
ampliamente dilatadas, no responden al estímulo luminoso, la presión arterial disminuye
constantemente, la frecuencia cardíaca y la frecuencia respiratoria se hacen
extremadamente irregulares. La muerte se produce por paro respiratorio más que por paro
cardíaco.
En la práctica, las manifestaciones
clínicas pueden ser de curso agudo o de curso crónico, en respuesta a los diversos
factores etiológicos que intervienen en la aparición de la HIC; su localización, su
amplitud y la velocidad de instalación (Cuadro N° 3).
7.1. Cefalea
Es el síntoma más común, producido por
la distensión de la duramadre, inervada en su porción supratentorial por la rama
oftálmica del nervio trigémino, por ello se localiza a nivel frontal y retroorbicular
bilateral; en su porción infratentorial está inervada por ramas del glosofaríngeo y
fibras sensitivas de los tres primeros pares de nervios cervicales, por lo que el dolor
tiene una localización occipitocervical. También intervienen las ramas terminales de los
nervios sensitivos que inervan a las arterias meníngeas, las venas, los senos y la
duramadre que cubre la base del cráneo, tienen también receptores sensitivos para el
dolor y la distensión.
La cefalea se describe como más intensa
al despertar del sueño, cuando se cambia de posición y cuando se producen las maniobras
de Valsalva. Generalmente es el primer síntoma, pero no es raro que aparezca en estadios
avanzados de la enfermedad. Puede ser difusa o circunscrita, otorgándole en este caso un
papel localizador de la lesión causal.
7.2. Vómitos
Los vómitos son generalmente matutinos,
no relacionados con las comidas. La presentación explosiva no es frecuente, aparece en
las fases finales de HIC. Puede producirse por la irritación directa de los núcleos
eméticos. En los tumores o quistes localizados en el piso del IV o III ventrículo,
produciendo el Síndrome de Bruns: vértigos intensos y vómitos desencadenados por los
cambios de posición de la cabeza.
7.3. Deterioro Mental
Son más frecuentes en la HIC de curso
avanzado, sobresale la Bradipsiquia, el paciente se muestra desinteresado, fatigable,
irritable, con gran inestabilidad emocional. El nivel de conciencia varía desde la
modorra leve, función intelectual alterada, somnolencia, estupor y coma. Si la PIC
aumenta rápidamente, la conciencia se compromete en igual medida; pero también puede
ocurrir que, la PIC por sí sola no produzca herniación cerebral, o no interferiera con
FSC o con la formación del edema cerebral difuso, no provocará alteraciones en el nivel
de la conciencia.
7.4. Signos Oculares y Pupilares
La midriasis y las pupilas fijas indican
disfunción cerebral severa. La midriasis unilateral es un signo localizador.
La miosis y la reacción tardía a la luz
indican lesión cerebral moderada. El edema de papila se produce por un deterioro en el
flujo axoplásmico, dando lugar al aumento de la presión intravaginal alrededor de nervio
óptico, seguido de transudación del fluido dentro del nervio. Casi siempre es bilateral,
aunque frecuentemente el grado de severidad es asimétrico.
El edema de papila demora días en
aparecer, con excepción de la presencia de hemorragia intracraneal severa, en la que
puede instalarse en el curso de 2 a 8 horas. El edema de papila temprano es expresión de
un bloqueo y éxtasis axoplásmico de la cabeza del nervio óptico; los cambios oculares
como hiperemia y congestión venosa son secundarios.
El edema de papila puede dar lugar a
obscurecimiento visual transitorio que dura menos de un minuto (ambliopía), diplopia
atribuible a la paresia del VI par u ocasionalmente por lesiones en la fosa posterior con
disminución progresiva de la agudeza visual. Agrandamiento del punto ciego, constricción
del campo visual periférico, hasta la ceguera cuando la papila llega a la atrofia final.
El edema de papila se presenta precozmente en los procesos que se desarrollan en la fosa
posterior.
7.5. Alteraciones cardiovasculares
Cuando la PIC aumenta lentamente, los
síntomas cardiovasculares no son aparentes, hasta que se alcanza un determinado umbral
crítico de presión, aparece un aumento progresivo de la PAM y un enlentecimiento de la
frecuencia del pulso, esto fue explicado por Cushing.
Cuando la presión externa que se aplica
sobre el bulbo raquídeo llega a ser igual a la presión diastólica o media, se produce
hipoxia de los centros raquídeos, lo que da lugar a hipertensión arterial producida por
vasoconstricción periférica mediada por vías de la médula cervical que se origina en
los Centros Vasomotores Bulbares, y que al ser estimulados ocasionan aumento de la
presión arterial, bradicardia, enlentecimiento o irregularidad de la respiración.
Los
mecanismos que permiten esta reacción se dan en el bulbo raquídeo intacto, ya que las
modificaciones cardiovasculares no se producen cuando el bulbo se halla dañado. Una
compresión prolongada del bulbo raquídeo, paraliza los centros bulbares, esto provoca
hipotensión, taquicardia y finalmente paro respiratorio. Este proceso se conoce como el
"Fenómeno de Cushing", y cuando se presenta tiene una significación clínica
de gran importancia; indica una amenaza de descompensación del equilibrio de las
presiones en la cavidad intracraneal; por lo que en la práctica clínica se tomarán con
urgencia las medidas necesarias para contrarrestar este proceso.
7.6. Alteraciones Respiratorias
La elevación rápida de la PIC da lugar
a la aparición de diversas alteraciones respiratorias. La respiración se hace irregular,
periódica, o con un patrón de Cheyne-Stoke típica, a veces se hace lenta, profunda y
ruidosa, con períodos de apnea que puede llegar al paro respiratorio y ser la causa de la
muerte, como lo señalaron Lermitt y Nortg. El edema pulmonar neurógeno es la
complicación más espectacular, su aparición es súbita, con la presencia de abundantes
secreciones bronquiales, que no es posible aspirar con eficacia, siendo por ello que el
índice de mortalidad es muy alto. La complicación más común y más significativa es la
atelectasia asociada con períodos de apnea prolongada.
7.7. Hernias Cerebrales
La hernia cerebral es el desplazamiento
del parénquima cerebral, a través de una incisura o un gran agujero del cráneo,
pudiendo ser unilateral o bilateral, tiene una topografía de presentación, y la
fisiopatología está en función de ella (Esquema N° 5).
a) Hernia transtentorial: resulta del
desplazamiento hacia abajo de los hemisferios y ganglios basales (núcleos basales)
comprimiendo el mesencéfalo; lo que determina transtorno progresivo del estado de
conciencia, midriasis pupilar, y alteraciones de la respuesta a la luz por compresión del
III par. Compromiso motor ipsilateral a la midriasis por compresión a la vía piramidal
del lado opuesto, (fenómeno de Kernohan) trastornos visuales, ataxia y ceguera
transitoria por compresión de la cintilla óptica o por compresión de la arteria
cerebral posterior. Alteración del reflejo vestíbulo ocular. Alteración de las
funciones vitales y autonómicas.
b) Hernia de las amígdalas cerebelosas:
Resulta del desplazamiento de las amígdalas cerebelosas, a través del agujero magno,
comprimiendo al bulbo y la protuberancia, fundamentalmente, dando lugar a la aparición de
bradicardia, trastornos respiratorios, vómitos vespertinos, disfagia por lesión del
neumogástrico, parestesias en los miembros superiores, hipotensión arterial, bradipnea,
paro respiratorio y muerte súbita.
c) Hernia del Uncus: Se produce cuando la
PIC es asimétrica, el Uncus del lado de la lesión se hernia a través de la tienda del
cerebelo, comprimiendo al mesencéfalo y el nacimiento del III par craneano, dando lugar a
anisocoria homolateral y compromiso motor del lado contralateral.
|
|
|
|
Herniación |
a)Transcallosa b)Lateral transtentorial c)Amigdalina |
d) Hernia de Girus Cingule: Ocurre cuando
una lesión expansiva hemisférica se hernia por debajo del borde libre de la hoz del
cerebro, comprimiendo el cuerpo del ventrículo lateral correspondiente. Los síntomas no
presentan particularidades especiales.
8. MÉTODOS DIAGNÓSTICOS
La HIC es una urgencia médica, por lo
tanto, se debe llegar al conocimiento de la causa, o etiología, con la rapidez necesaria
para evitar mayores complicaciones y mayor daño cerebral, por ello actualmente no existe
un patrón o secuencia rígida en el proceso de evaluación. Luego de una buena historia
clínica debe utilizarse el examen auxiliar más apropiado para el proceso en estudio.
8.1. Historia Clínica
La historia clínica adecuadamente
recabada permite llegar a un diagnóstico presuntivo oportuno de la HIC; para ello debe
realizarse un análisis semiológico de cada uno de los síntomas y signos, poniendo
énfasis en aquéllos de aparición temprana, como la cefalea, vómitos, trastornos
visuales, cambios en el estado de conciencia, etc. Asimismo, debe indagarse sobre
episodios traumáticos anteriores, patología previa. El examen clínico debe ser prolijo,
especialmente el examen neurológico.
Los exámenes auxiliares por imágenes
deben iniciarse por aquellos métodos no invasivos y más apropiados, para, de ser
necesario, en una segunda instancia, usar los métodos invasivos.
8.2. Radiografía de Cráneo
Permite apreciar si la glándula pineal
calcificada ha sido desplazada de la línea media, alejada por una masa en expansión. En
la HIC de curso crónico pueden apreciarse la descalcificación de la apófisis clinoides
posteriores, agrandamiento aparente de la silla turca, impresiones digitales o
cerebriformes en la tabla interna del cráneo en pacientes menores de 30 años; diastasis
de las suturas craneales en los más jóvenes.
Pueden apreciarse calcificaciones
anormales que puedan corresponder a tumores que presenten calcificaciones, o a las
malformaciones arteriovenosas (Fotos 1 y 2).
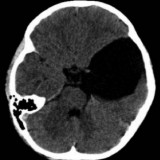
8.3. Tomografía cerebral
computarizada y resonancia magnética nuclear
Deben ser los primeros exámenes a
solicitar debido a que proporcionan una información más cabal de lo que ocurre a nivel
intracraneal, incluyendo la etiología posible, lo cual permitirá adoptar la conducta
terapéutica más apropiada. Debido a que la etiología es diversa, no es posible hablar
de imágenes características. Se aprecian imágenes de hipodensidad en la TAC que
expresan la presencia de edema cerebral; aunque la RMN lo puede mostrar más precozmente.
Los procesos tumorales expansivos son fácilmente detectados por la TAC, pero son más
evidentes con la RMN (Fotos 3-6). En la hidrocefalia se aprecian alteraciones
estructurales que pueden permitir identificar la causa de ella. La RMN es muy importante
para valorar los problemas medulares e intrarraquídeos que impiden la circulación así
como la reabsorción del LCR.
8.4. Angiografía Cerebral
Tiene la finalidad de mostrar las
alteraciones de la circulación cerebral en sus diversas formas: Desplazamiento de su
trayecto normal, cambios en su calibre, neovascularización en el caso de procesos
tumorales malignos, cambios en la velocidad y tiempos circulatorios que dan lugar a
superposición de fases. Cambios en los ángulos de desagüe en los senos venosos.
Concretamente los estudios angiográficos muestran la morfología de los vasos grandes y
pequeños, y su relación con los estados patológicos en evaluación.
9. MANEJO DE LA HIPERTENSIÓN
INTRACRANEAL (HIC)
En el manejo del paciente con HIC,
primero debe identificarse la etiología del proceso, mediante estudios diagnósticos, de
acuerdo a ello el tratamiento puede ser médico o quirúrgico.
|
|
|
|
(1)
|
(2)
|
|
|
|
|
(3)
|
(4)
|
|
(1) Impresiones |
|
|
|
 |
| (1) | (2) |
 |
 |
| (3) | (4) |
|
(1) Tumor Quístico del |
|
El paciente con HIC deberá ser instalado
en una Unidad de Cuidados Intensivos Neuroquirúrgicos para monitorizar las constantes
más importantes: Presión venosa central, presión intra-arterial y de ser necesario
cateterización de la arteria pulmonar, monitorización de la presión intracraneal,
especialmente en pacientes con injuria cerebral severa, hemorragia ganglionar de gran
volumen, edema cerebral masivo por infarto cerebral, hemorragia subaracnoidea y en el
postoperatorio inmediato de grandes operaciones intracraneales.
El manejo de la PPC debe considerarse
como una guía importante para la instalación del tratamiento porque la reducción de la
PIC aumentada implicará propósitos muy importantes, como:
– Disminución del volumen tisular
cerebral (deshidratación osmótica).
– Disminución del volumen sanguíneo
cerebral por disminución del FSC o promoción del drenaje venoso cerebral.
– Retiro de LCR por drenaje ventricular.
– Remoción o descompresión de una masa
intracraneal agregada.
La disminución del VSC puede ser
conseguida por una disminución de la PaCO2. La disminución de PAM disminuye el FSC,
pero, si el sistema de regulación se ha hecho defectuoso, a causa de la lesión se
producirá isquemia. Igualmente si la autorregulación es inadecuada un incremento de la
PAM aumentará el FSC y el VSC, dando como resultado un incremento de la PIC.
Por ello, el manejo de la HIC involucra
primero medidas de orden general y luego medidas o tratamientos de orden específico.
9.1. Medidas de Orden General
– Los pacientes deben ser oxigenados
adecuadamente y la PAM debe ser mantenida en niveles óptimos.
– La fiebre debe ser investigada y
tratada agresivamente, con mantas heladas o fármacos antitérmicos.
– En los pacientes que presentan
disautonomía o las llamadas convulsiones diencefálicas (episodios súbitos de
taquicardia, taquipnea, aumento de la temperatura por encima de 41° C, escalofríos
intensos) usamos una combinación de morfina y bromocriptina.
– La posición de la cabeza debe ser
neutra, para reducir cualquier compresión de las venas yugulares, que impediría el flujo
de salida venoso intracraneal. La cabeza debe ser elevada a una altura de 30°; en esta
posición se ha demostrado una disminución importante de la PIC.
– Se deben aspirar regularmente las
secreciones bronquiales, para evitar la hipoxemia, pero el pasaje del catéter
endotraqueal no debe ser reiterado. Si se incrementa la PIC durante el procedimiento, se
debe aplicar de modo profiláctico un bolo de lidocaína endovenosa a la dosis de 1
mg/kg/peso.
– Se debe mantener un estado euvolémico,
para que la restricción de fluidos, concomitantemente con la administración de
soluciones deshidratantes no causen hipotensión arterial, hemoconcentración o incremento
de la PA, lo que daría lugar a efectos muy deletéreos.
– Las convulsiones incrementan la PIC,
pudiendo dar lugar a acidosis respiratoria, aspiración bronquial e hipoxemia. La
profilaxis con drogas anticonvulsivantes debe utilizarse en pacientes con parénquima
cerebral, todavía complaciente y en aquéllos en quienes el riesgo de convulsiones es
alto.
– El manejo de la presión arterial no es
fácil. Se puede argüir que la HTA produce vasoconstricción en las áreas de
autorregulación intacta, reduciendo con ello la PIC; pero la experiencia señala que en
los pacientes con gran injuria cerebral, la autorregulación es defectuosa, por ello debe
evitarse el uso de antihipertensivos sobre todo, aquellos que producen vasodilatación
como la hidralazina y el nitroprusiato, los que pueden dar lugar a valores de la PAM
inaceptables.
9.2. Medidas de orden específico
1) Drenaje del LCR: Se realiza mediante
cateterización del ventrículo lateral, como una medida racional en casos de incrementos
súbitos de la PIC. Se usa en pacientes con hidrocefalia aguda, como en el caso de
hemorragia subaracnoidea masiva, masas expansivas localizadas en la fosa posterior;
pacientes con injuria cerebral cerrada severa; pacientes con traumatismo craneocefálico
severo, cuando es posible todavía el cateterismo ventricular, y cuando se monitorea la
PIC.
2) Hiperventilación: En los casos en que
está indicado, este procedimiento es de gran utilidad porque permite controlar cualquier
elevación de la PIC. La hiperventilación causa disminución de la PIC por
vasoconstricción cerebral, dando lugar a disminución del FSC. La vasoconstricción está
mediada por cambios en el pH de LCR. El FSC disminuye en, aproximadamente, un 40% en el
lapso de 30 minutos después de que la PaCO2 alcanza alrededor de 25 mmHg; pero si la
hiperventilación se prolonga por muchos días el FSC aumentará hasta un 90% sobre el
valor basal, no aconsejándose por ello esta forma de tratamiento.
El control del pH del LCR se corrige
usando amortiguadores como el bicarbonato, aunque el tiempo es medianamente efectivo en
algunas horas.
La hiperventilación también puede ser
perjudicial en pacientes con enfisema pulmonar, obesidad muy marcada, pues ellos están
asociadas con retención de CO2 y la súbita disminución de la PaCO2 es causa de
hipotensión significativa.
La hiperventilación debe instalarse con
una frecuencia respiratoria de 20 por minuto y en volumen tidal de 12 ml/kg mantenida como
normal; el incremento de ambos factores ventilatorios puede elevar la presión en la vía
aérea dando lugar a barotrauma y en casos extremos a neumotórax.
El destete de la ventilación debe ser
gradual; la ventilación debe reducirse en dos inspiraciones por minuto/l, junto con un
monitoreo cuidadoso de la PIC, este tratamiento es muy eficaz cuando se usa adecuadamente,
su uso profiláctico y prolongado por más de 2 días no es recomendable. La
hiperventilación tiene mejor resultado cuando se asocia al uso de terapia osmótica. Este
tratamiento puede usarse muchas veces, pero por períodos cortos, cuando se considere
necesario.
La saturación del O2 es importante, por
eso debe evaluarse a nivel de la vena yugular la diferencia arteriovenosa de O2
monitorizándose, para valorar la profundidad de la hiperventilación, pues si ésta es
muy vigorosa, extrae demasiado O2 incrementando la diferencia de la saturación
arteriovenosa y conduciendo al cerebro hacia la isquemia severa.
3) Diuréticos Osmóticos:
El principio básico de la Osmeoterapia,
es disminuir el H2O del parenquima cerebral. Para que los agentes osmóticos trabajen es
necesario un gradiente osmótico y una BHE intacta, así podrá producirse la
deshidratación del tejido cerebral no injuriado.
Los diuréticos osmóticos más usados
son el manitol, la solución salina hipertónica, la albúmina y el glicerol. La
furosemi-da, diurético de haza puede ser usada.
• Manitol: Actúa por una
variedad de mecanismos:
a) Desplazamiento del H2O cerebral al
espacio vascular.
b) Aumento del FSC por hipervolemia
transitoria.
c) Hemodilución y disminución de la
viscosidad sanguínea.
d) Mayor transporte de O2 por cambios en
la plasticidad celular y velocidad circulatoria.
e) El manitol al parecer incrementa la
velocidad de absorción del LCR.
• El manitol: Se usa en
solución al 20%, una dosis inicial de 1 a 2g/kg/peso aplicado en bolo durante 15 a 20
minutos, para luego reducirla a una dosis de mantenimiento de 0,25-0,50 g/kg cada 4 horas.
Muy rara vez se necesitan dosis más altas. El objetivo debe ser una osmolaridad sérica
de 300-310 msm/l, pues una osmolaridad mayor de 315 msm/l llevaría a la insuficiencia
renal por deshidratación.
Se señala que puede presentarse una
respuesta de rebote, llevando a la PIC a niveles muy altos, pero no se ha aclarado la
causa, en su relación con la dosis de administración, la velocidad de infusión o en el
intervalo de su aplicación.
• Furosemida: Si no se
encuentra una respuesta adecuada con el uso de manitol desde un inicio, y si los estudios
auxiliares por imágenes excluyen la presencia de masa intraparenquimal, la furosemida a
la dosis de 40 mgr puede ser administrada especialmente en presencia de insuficiencia
cardiaca congestiva que pudo haberse desencadenado por la administración de manitol.
También puede usarse una combinación de
furosemida con albúmina en una solución hipertónica al 3% en un volumen de 50 cc
aplicado en 10 minutos.
• Barbitúricos: Su uso ha
sido propuesto particularmente en injurias cerebrales severas, como un recurso en
pacientes con HIC refractaria que no han respondido a otras modalidades de tratamiento.
Está indicado en un porcentaje reducido de paciente porque la complejidad de su uso es
muy grande; produce disfunción cardiaca e hipotensión arterial de manejo muy difícil;
existe también un mayor riesgo de infecciones nosocomiales por depresión del
aclaramiento ciliar de las mucosas.
Aproximadamente el 50% de los pacientes
tratados con barbitúricos necesitan agentes inotrópicos para el control de la presión
arterial, usando una combinación de Dobutamina y Epinefrina, más fluidos adicionales.
Éstos requieren un catéter de Swan-Ganz con monitoreo hemodinámico regular y
determinación frecuente de los niveles séricos del barbitúrico en uso.
El tratamiento barbitúrico es iniciado
con Pentobarbital a la dosis de 10 mg/kg/peso en 30 minutos y una dosis de mantenimiento
de 1 a 3 mg/kg/hora en infusión EV continua; dosis más altas como 5 mg/kg/h pueden ser
usadas adicionalmente por muchas horas como dosis de carga adecuada.
El volumen apropiado se consigue
monitoreando la presión en cuña de los capilares pulmonares, la cual debe estar dentro
de los rangos normales de 12 a 14 mmHg. La presión arterial debe mantenerse con infusión
de dopamina de 5 a 10 ug/kg/min. La supresión y el trazado plano del electroencefalograma
es usualmente visto cuando los niveles séricos de barbitúricos alcanzan 30 a 40 ugr/dl
por lo que los niveles séricos deben ser controlados con regularidad.
El tratamiento barbitúrico debe
mantenerse por 2 ó 3 días; sino hubiera respuesta se le debe interrumpir. Si la PIC ha
sido controlada el tratamiento debe ser retirado lentamente reduciendo a un 50% el
porcentaje de infusión cada día.
• Corticoides: Los
corticoides, especialmente la Prednisona y la Metilpredinosolona, así como la
Dexametasona han sido usados en pacientes con injuria cerebral severa, en especial para la
reducción del edema cerebral peritumoral. Se le han atribuido efectos neuroprotectores
por su posible actividad antioxidante lipídica; pero, sus efectos adversos, como
hiperglicemia, sangrado de la mucosa gastrointestinal, así como un incremento de las
infecciones sistémicas por efectos inmunosupresivos, hacen que en la actualidad su uso se
haya tornado controversial.
• Descompresión Quirúrgica: Es el método elegido cuando el factor etiológico es una masa intracraneal que ocupa
espacio e incrementa el volumen intracraneal: tumores cerebrales, hematomas, hidrocefalia
hipertensiva aguda, edema cerebral masivo secundario a infarto cerebral.
Dr. Jaime Samaniego Zamaniego





















buen aporte, muchas gracias!!!
muy bueno, solo que hipotensión,taquicardia?
tengo dudas. en la triada de cushing
Soy Prof Nac Educ Fís, Auxiliador de Cruz Roja , Socorrista para Zonas Agrestes y miembro del Grupo de Busqueda y Rescate Esquel.(53 años) Dicto Cursos y Capacitaciones de Primeros Auxilios. Ingresé a la pág. para buscar y aumentar información. Necesito información para tratamiento de PIC en zonas agrestes (mas de 2 hs de traslado al centro de atención definitivo) y fotografías de pupilas (miosis, midriasis, anisocoria) . De ser posible información del porqué se produce cada una. Agradezco su atención. Juan Carlos Nahirñak Avda Fontana 319 – (9200) Esquel Prov de Chubut Argentina . Cel 02945 15410558